或扫码获取报告

肿瘤的复发:微小残留病灶MRD。在肿瘤患者接受治疗后,尽管从影像学上似乎彻底清除了病灶,但仍有极少量未被检测到的肿瘤细胞残存或肿瘤细胞来源分子异常。这些残存的肿瘤病灶被称之为微小残留病灶(Minimal Residual Disease,MRD)或分子残存病灶(Molecular Residual Disease)。MRD具有与原始肿瘤细胞相同或相似的表型和遗传特征,可能仍拥有导致肿瘤复发的能力。
对MRD的检测:基于肿瘤的生物学和生理特征,肿瘤组织在代谢和增殖等生理过程中向循环系统释放许多细胞或分子。用于血液瘤MRD检测的主要生物标志物是循环肿瘤细胞(Circulating Tumor Cells,CTC)。对于实体瘤,其通常将循环肿瘤细胞(CTC)和循环肿瘤DNA(circulating tumor DNA,ctDNA)释放到体液中,但由于早期实体瘤很少释放CTC到循环系统中,而ctDNA在所有阶段的肿瘤中都会持续释放,并且与肿瘤动力学高度相关,因此是目前用于实体瘤MRD检测的主要标志物。
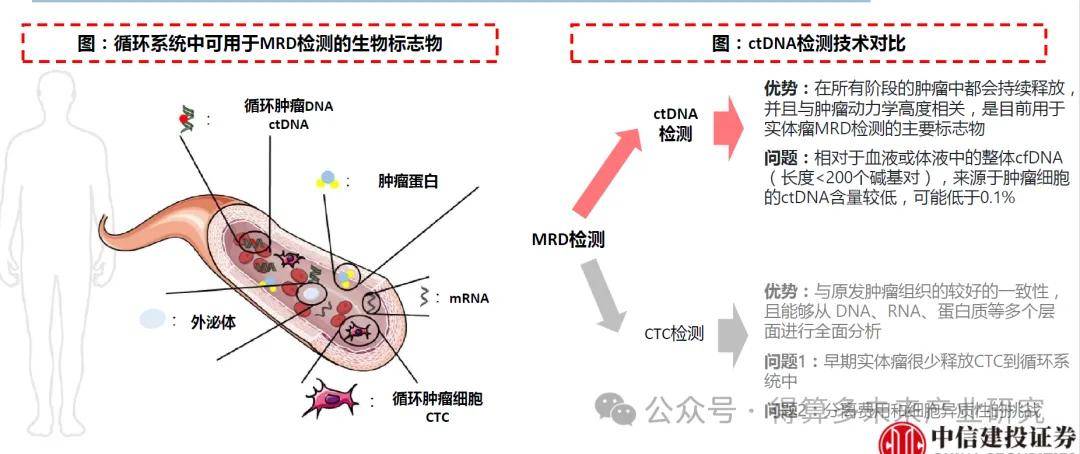
基于癌症特异性突变检测ctDNA。ctDNA可以根据各种基因组特征进行检测,包括癌症特异性突变(cancer specific mutations)、甲基化、拷贝数变异(CNV)或ctDNA的其他特征等。癌症特异性突变检测是最常用于检测ctDNA的基因组特征。
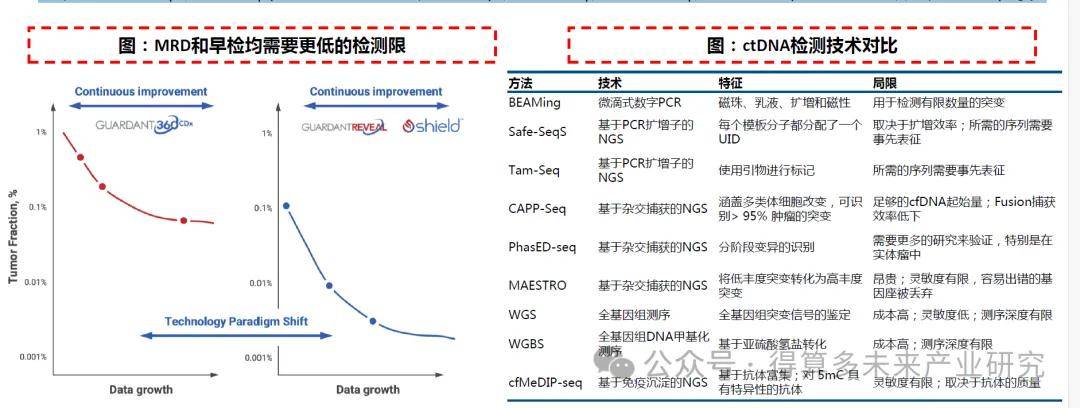
NGS+定向检测:灵敏度和广度的平衡。由于此前提到的在血液或体液整体cfDNA中,肿瘤相关ctDNA含量较低,因此使得癌症特异性突变的频率通常较低。最初基于ddPCR的方法BEAMing实现了较好的灵敏度,但可检测突变数量十分有限。基于NGS的方法可以对患者样本的大量DNA模板进行高通量测序,但灵敏度较低,由于NGS错误率导致罕见突变难以被检测。因此将NGS与定向的检测方法相结合能够对ctDNA中的大量突变进行多重检测,在保证广度的同时也尽可能的提高了NGS检测的灵敏度。近年来已被开发的技术包括Safe-SeqS、Tam-Seq(基于PCR扩增子的靶向NGS)、CAPP-Seq、PhasED-seq、MAESTRO(基于杂交捕获的靶向NGS)等。
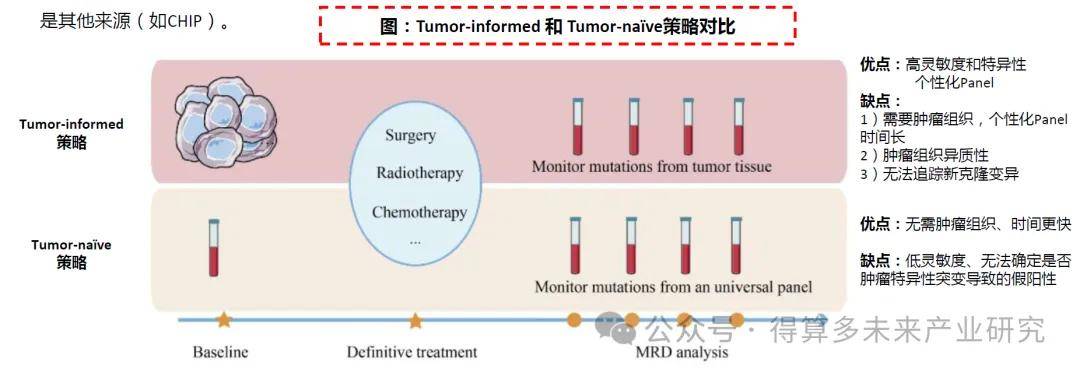
Tumor-informed可能是更优策略。目前基于ctDNA进行MRD分析有两种策略:Tumor-informed(依赖肿瘤组织信息)和Tumor-naïve(与肿瘤类型无关的固定Panel)。
Tumor-informed策略:对患者原发肿瘤组织进行WES测序,鉴定患者的特异基因组变异,定制化筛选、设计监测Panel进行个性化的ctDNA检测分析。该策略可实现较高的灵敏度和特异性,个性化Panel可获取患者携带的特有变异。但该方法需要足够的肿瘤组织。此外,肿瘤中存在异质性,因此Tumor-informed方法可能会由于组织样本偏差而错过一些突变。Tumor-informed分析也无法追踪随访期间出现的新克隆变异。
Tumor-naïve策略:固定化Panel,也称Tumor-agnostic,通过预先选定的引物/探针设计与癌症类型相关的panel,检测ctDNA突变或甲基化等特征。该方法优点为无须原发肿瘤组织,时间更快。缺点包括灵敏度可能较低,以及无法确定突变是否为肿瘤特异性还是其他来源(如CHIP)。
Natera:MRD产品适应症持续拓展并获医保纳入
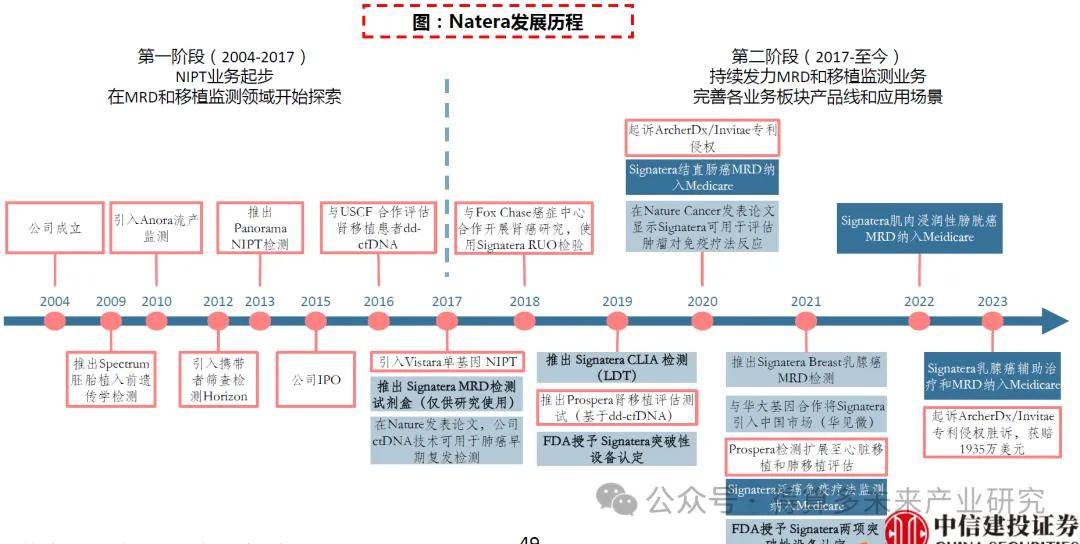
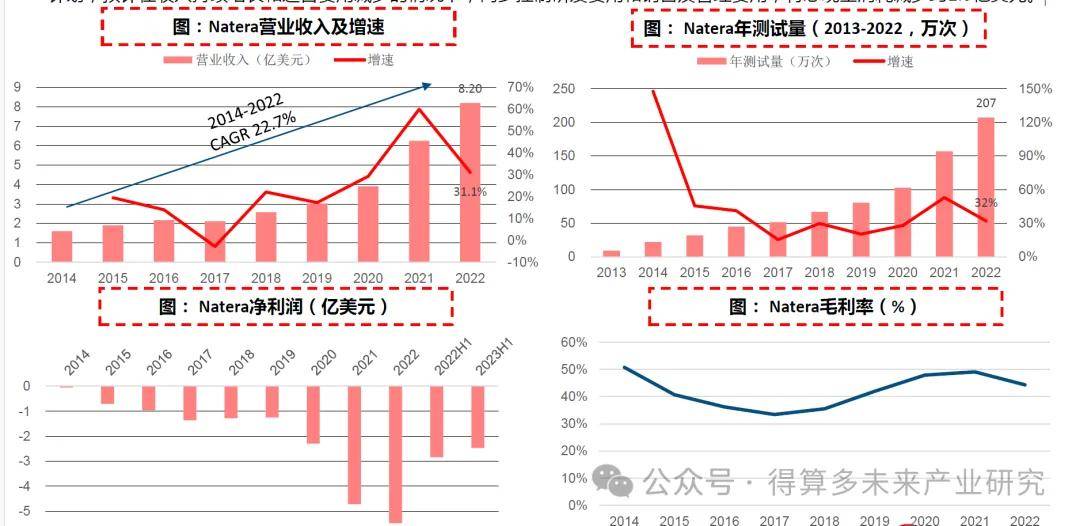
基于cfDNA检测开发系列产品。Natera成立于2004年,结合分子生物学技术和生物信息学分析打造了cfDNA技术平台,并开发了系列产品,公司发展初期依靠无创产前检测NIPT业务起步作为核心业务,此后在MRD和移植监测领域持续发力,2017年推出高精度和个性化MRD检测产品Signatera,2019年推出Prospera肾移植评估测试,同时快速推进临床研发、扩大病种应用。2015年公司在纳斯达克上市,2022年公司营收8.20亿美元。
测试量不断提升,营收保持高增长。公司在过去十年不断丰富三大业务线产品,推动测试量增长,2022年公司年测试量已突破200万次。受测试量驱动公司营收快速增长,2022年营收8.2亿美元,2014-2022营收CAGR达22.7%。2017年之后随着MRD和器官移植业务发展,毛利率从30%回升至50%左右。目前公司仍处于亏损状态,但亏损趋势已有缩窄,2023年公司发布全年控费计划,预计在收入持续增长和运营费用减少的情况下,同步控制研发费用和销售及管理费用,将总现金消耗减少约1.5亿美元。
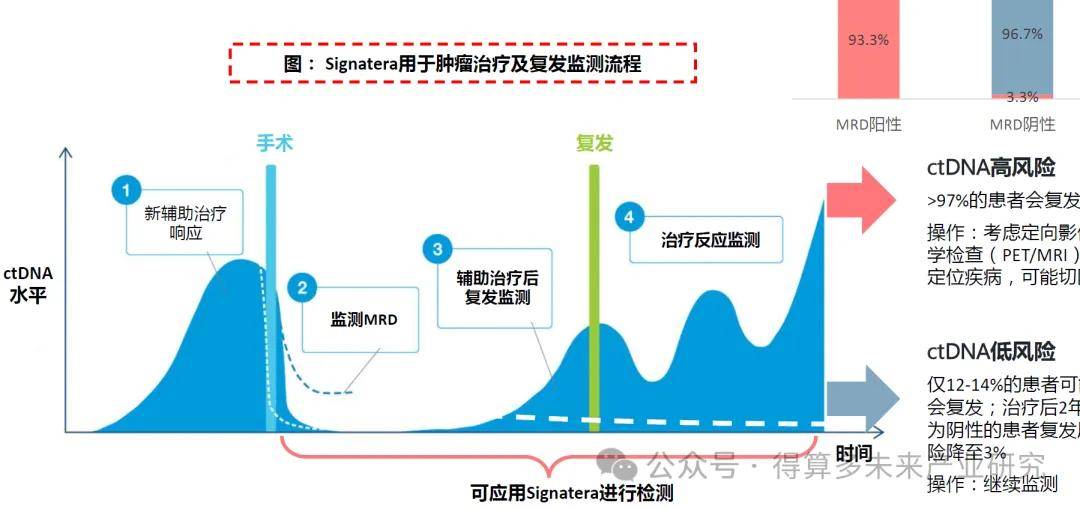
Signatera:Tumor-informed策略MRD检测代表产品
Signatera™:Tumor-informed策略MRD检测。2017年,公司推出Signatera RUO版本,基于ctDNA提供高灵敏度和个体化的MRD检测,当时仅限癌症研究人员和生物制药公司用于研究使用;2019年,公司商业化发布Signatera,可在CLIA和CAP认证实验室以LDT方式使用。2019到2021年Signatera获得FDA授予3项突破性设备认定。
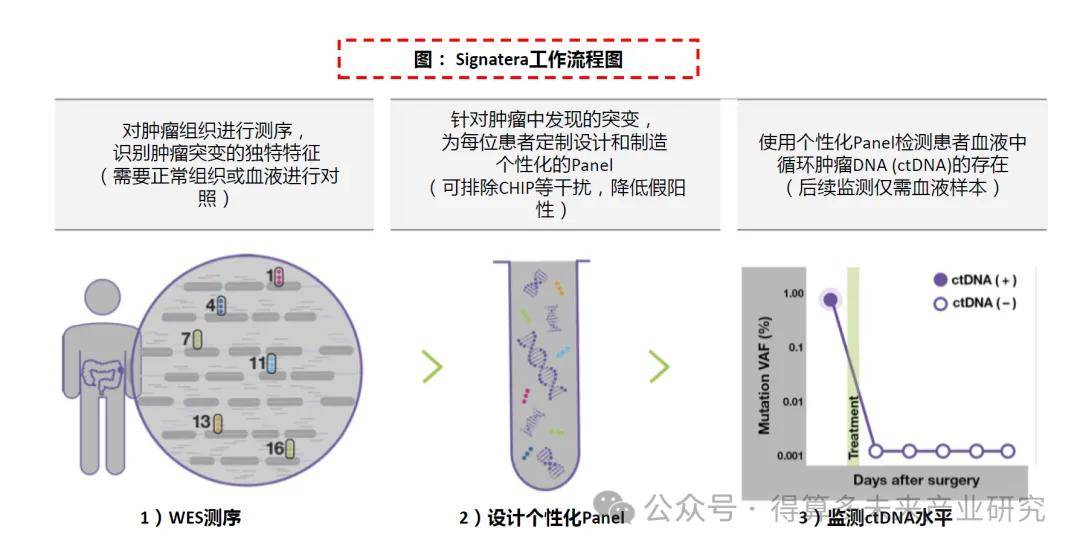
“WES+个性化Panel”,监测突变数量和灵敏度占优:Signatera采用“Tumor-informed”策略,通过每个患者组织样本WES检测结果与正常组织或血液进行对照,设计定制后续追踪突变位点的个体化Panel进行监测,报告是否检测到循环肿瘤DNA(ctDNA),并为纵向评估提供每毫升平均肿瘤分子数(MTM/mL),可监测的突变数量多、灵敏度高。
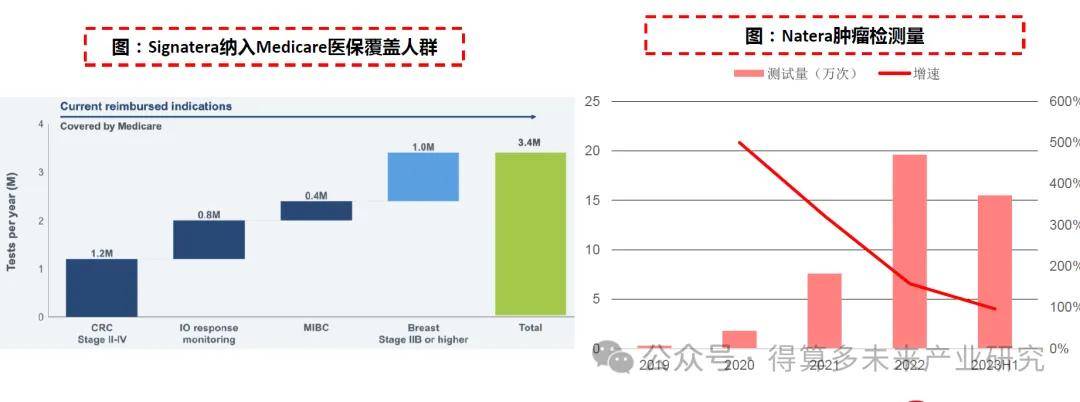
适应症持续扩展并被纳入Medicare。自推出以来Signatera的适应症范围持续拓展,且相继被Medicare纳入医保报销范围。目前Medicare覆盖范围已经包括了II、III期结直肠癌MRD监测(2020年纳入)、泛癌免疫治疗疗效监测(2021年纳入) 、肌肉浸润性膀胱癌MRD监测(2022年纳入)和IIB期及以上乳腺癌MRD监测(2023年纳入)四大方向。医保纳入扩展产品应用的市场空间,目前Signatera针对Ⅱ-Ⅳ期结直肠癌、泛癌免疫治疗疗效监测、肌肉浸润性膀胱癌、IIB期及以上乳腺癌监测可覆盖的Medicare报销人群分别为120万、80万、40万和100万,总人群达340万。
肿瘤检测业务快速放量:根据公司披露,截至目前已有超过30%的美国肿瘤专家订购Signatera,新客户数量持续增长,2022年肿瘤检测量达19.6万次,2023年上半年已超15万次,在各项肿瘤MRD的使用率均有上升。
积极推进临床试验,数据支撑医保纳入。CMS的Palmetto MolDX项目在建议将某项检测纳入医保之前通常会先公布LCD(localcoverage determination),可以看到LCD会突出已发表的文章情况,例如将Signatera检测结直肠癌MRD纳入医保时,MRD结果的高灵敏度,以及和无复发生存期的相关性被着重强调。目前,公司Signatera产品已在结直肠癌、乳腺癌、肺癌、卵巢癌、膀胱癌、多发性骨髓瘤、食管癌等十余种癌症开展临床试验并获得阳性结果,预测癌症复发的整体敏感性在88%-100%,特异性在98%-100%。医保覆盖工作有望持续推进。

未来展望:癌种持续拓展,临床数据读出推动指南纳入和医保覆盖
癌种持续拓展,推动指南纳入。目前,公司Signatera产品已在结直肠癌、乳腺癌、肺癌、卵巢癌、膀胱癌、多发性骨髓瘤、食管癌等十余种癌症开展临床试验,预测癌症复发的整体敏感性在88%-100%,特异性在98%-100%。部分已被纳入报销范围的癌种如结直肠癌和乳腺癌,对于不同亚型及不同试验类型的临床也正陆续开展,通过多项前瞻性和RCT试验进一步获取临床证据,有望推动指南纳入和医保覆盖。



